Понимание буфера угольной кислоты / бикарбоната в гидропонике — Наука в гидропонике
![]()
![]()
![]()
![]()
Я уже писал несколько статей о рН и его важности в гидропонной культуре (1, 2, 3, 4). Однако мне еще предстоит написать подробное объяснение одной из самых важных буферных систем в гидропонике, а именно угольно-бикарбонатного буфера. Этот буфер значительно сложнее, чем более простой буфер, созданный с использованием соединений фосфорной кислоты, поскольку он зависит не только от ионов, присутствующих в растворе, но и от парциального давления углекислого газа в атмосфере. В этой статье я попытаюсь подробно объяснить эту систему буферизации, пролить свет на ограничения этого буфера и то, как изменение различных ключевых переменных может коренным образом повлиять на то, как он работает в гидропонике.
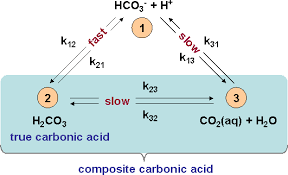
Буфер — это не что иное, как пара химических частиц в растворе, которые присутствуют при определенном pH и могут реагировать с дополнительным H.3ионы О+ или ОН-, которые вводятся в раствор. Поскольку эти ионы контролируют значение pH, все, что препятствует изменению их концентрации, будет поддерживать стабильный pH. Дистиллированная вода, например, абсолютно не обладает буферной способностью, так как в ней нет ничего, что могло бы вступить в реакцию с поступающим H.3О+ или ОН– ионы, которые добавляются в раствор. Следовательно, дистиллированная вода должна иметь рН 7,0, а не потому, что мы живем в среде, где кислота всегда может образовываться из воздуха. Эта кислота – угольная кислота – образуется в воде всякий раз, когда она контактирует с атмосферой, содержащей углекислый газ. Это делает дистиллированную воду с pH около 5,6..
Чтобы иметь возможность рассчитать pH, нам нужно учитывать все химические равновесные реакции, которые происходят, они суммированы здесь и на изображении выше. Мы должны учитывать, что углекислый газ будет растворяться в воде, чтобы всегда удовлетворять закону Генри, что растворенный углекислый газ будет находиться в равновесии с угольной кислотой, что угольная кислота может диссоциировать на H3О+ ион и ион бикарбоната, и что ион бикарбоната может далее диссоциировать на дополнительный H3ион О+ и карбонат-ион. Чтобы решить все это, мы также должны учитывать, что должна сохраняться нейтральность заряда, а это означает, что сумма всех молярных зарядов всех положительных ионов должна быть равна молярным зарядам всех отрицательных ионов. Для выполнения этих расчетов я обычно использую бесплатное программное обеспечение Maxima. Ниже вы можете увидеть код, который я использую для решения этой системы в Maxima (константы взяты отсюда):
[kw : 10^(-14.0), kh: 1.7*10^(-3.0), kc1: 2.5*10^(-4.0), kc2: 4.69*10^(-11.0), co2: 1.32*10^-5]; log10(x) := log(x)/log(10) ; pH(x) := float(-log10(x)); float(solve([h*oh=kw, h = 2*co3+hco3+oh, kh=h2co3/co2, kc1=(hco3*h)/h2co3, kc2=(co3*h)/hco3],[oh, co3, hco3, h2co3, h]));
This is the solution obtained for the molar concentrations (rounded for clarity): oh = 4.21*10^-9 co3 = 4.68*10^-11 hco3 = 2.36*10^-6 h2co3 = 2.24*10^-8 h = 2.37*10^-6
После выполнения этого кода вы получите несколько различных возможных решений, но нас интересует только то, где H3О+ (h) концентрация — положительное число (это решение показано выше). Затем мы можем использовать функцию pH, чтобы вычислить значение pH для этого H30+, что дает нам значение 5,62, это соответствует реальному измерению раствора дистиллированной воды при 25°C в атмосфере углекислого газа 387 ppm. Обратите внимание, что количество недиссоциированной кислоты в растворе очень мало. В пересчете на массу концентрация угольной кислоты составляет 0,00138 ppm. Однако концентрация бикарбоната значительно выше, в 3,6 раза выше концентрации недиссоциированной угольной кислоты. Это объясняет, почему pH так сильно падает, поскольку значительное количество образующейся угольной кислоты в конечном итоге диссоциирует и вносит H3О+ ионы в раствор. Это также показывает, как мало кислоты требуется для снижения pH незабуференного раствора.
Чтобы создать буфер с максимально возможной силой, нам потребуется добавить достаточное количество сильного основания, чтобы сдвинуть pH до точки, где pH равен pKa (что равно -Log (константа равновесия)) совместных реакций, созданных из реакции углекислого газа с водой с образованием угольной кислоты и последующей диссоциацией этой кислоты на бикарбонат и H3О+. Эта точка составляет 6,3 при атмосферных условиях при 25°С. Этого можно добиться с помощью приведенного ниже кода:
[kw : 10^(-14.0), kh: 1.7*10^(-3.0), kc1: 2.5*10^(-4.0), kc2: 4.6910^(-11.0), co2: 1.32*10^-5, h:10^(-6.3)]; float(solve([hoh=kw, base+h = 2co3+hco3+oh, kh=h2co3/co2, kc1=(hco3h)/h2co3, kc2=(co3h)/hco3],[oh, co3, hco3, h2co3,base]));
This is the solution obtained for the molar concentrations(rounded for clarity): oh = 1.99*10^-8 co3 = 1.04*10^-9 hco3 = 1.11*10^-5 h2co3 = 2.24*10^-8 base = 1.07*10^-5
pH здесь установлен на 6,3, и мы видим, что для этого нам нужно добавить основание в концентрации 1,07*10.-5,0. Если бы этим основанием был КОН, это означало бы добавление его со скоростью 0,6 частей на миллион. С этого момента мы можем видеть, как изменяется рН в зависимости от добавления основания или кислоты. Если в этот момент мы решим удвоить добавление сильного основания, мы получим 6,57, утроив его, мы получим 6,73, а добавление в 10 раз больше основания приведет нас к 7,25. Буфер действительно противостоит увеличению pH, в основном вытягивая CO.2 из воздуха, чтобы реагировать с поступающим основанием, когда основание добавляется к раствору. Однако вы можете заметить, что в равновесных условиях буферная способность этой системы очень низкая.. Всего лишь 6 частей на миллион сильнощелочного эквивалента KOH могут сильно повлиять на pH, подняв его с 5,6 до 7,25. Так как же буфер угольной кислоты/бикарбоната вообще может быть эффективным в гидропонике?
Ответ на первой картинке в этом посте. Равновесная реакция между угольной кислотой и водой плюс диоксид углерода в воде (k23/k32) принципиально медленная. Мы можем воспользоваться этим, генерируя большее количество карбонатных соединений в растворе за счет добавления экзогенных карбонатов или бикарбонатов, а затем устанавливая более низкое значение pH для образования большего количества угольной кислоты, этой кислоте потребуется значительное время для достижения равновесия. . По этой причине использование водопроводной воды со значительно более высокой щелочностью может обеспечить неожиданно более сильный буфер, чем можно было бы ожидать при равновесии, и это также имеет некоторые интересные последствия при использовании питательных растворов.
Давайте рассмотрим случай, когда разложение угольной кислоты не происходит — предположим, что оно очень медленное — и скажем, мы добавляем 100 частей на миллион карбоната калия в раствор, а затем устанавливаем рН обратно на 5,8 с помощью фосфорной кислоты. В этом случае преобладающими реакциями в растворе будет диссоциация дигидрофосфата на гидрофосфат и H3O+ и диссоциация угольной кислоты обсуждались ранее. Чтобы правильно рассмотреть этот случай, мы должны также ввести два дополнительных уравнения, в основном уравнения баланса массы для фосфатов и карбонатов, поскольку на этот раз мы предполагаем, что углекислый газ никогда не теряется в атмосфере. Обратите внимание, что здесь я изменил константу равновесия реакции с угольной кислотой на 10.-6,3 где угольная кислота теперь является «кажущейся угольной кислотой». Вы можете увидеть систему уравнений и решение ниже:
[kw : 10^(-14.0), kh: 1.7*10^(-3.0), kc1: 10^-6.3, co2: 1.32*10^-5, kp:10^-7.2, total_p: 1.7*7.2310^-4, total_c: 7.23*10^-4]; float(solve([h*oh=kw, total_c=hco3+h2co3, total_p=h2po4+hpo4, 2*total_c+h = hco3+oh+h2po4+2*hpo4, kc1=(h*co3h)/h2co3, kp=(hpo4*h)/h2po4],[hco3, h2co3, h2po4, hpo4, h, oh]));
This is the solution obtained for the molar concentrations(rounded for clarity): hco3 = 1.72*10^-4 h2co3 = 5.50*10^-4 h2po4 = 0.00118 hpo4 = 4.64*10^-5 h = 1.60*10^-6
Конечный pH этого раствора очень близок к 5,8, а концентрация P составляет 47,9 частей на миллион с K на уровне 38,10 частей на миллион. Обратите внимание, однако, что кажущаяся угольная кислота имеет концентрацию 5,50*10-4 M, что означает, что система не находится в равновесии, поскольку это количество значительно больше, чем можно было бы ожидать по закону Генри. Если мы уменьшим концентрацию угольной кислоты вдвое, то рН увеличится до 6,01, как и следовало ожидать при извлечении кислоты из раствора. Подразумевается, что со временем pH этого раствора будет медленно увеличиваться, поскольку угольная кислота разлагается, и раствор достигает равновесия с уровнем углекислого газа в атмосфере. По этой же причине питательные растворы, которые готовятся из водопроводной воды с высоким содержанием карбонатов, а затем аэрируются, имеют тенденцию к быстрому увеличению pH — даже если раствор не подается растениям — поскольку достижение равновесия ускоряется за счет перемешивания воды. раствор и контакт с воздухом (что позволяет CO2 в решении побега).
Как только приготовлен вышеуказанный раствор, он обеспечивает значительно более высокую буферную способность по сравнению с раствором, содержащим только фосфаты. Вот почему вода с высокой щелочностью имеет тенденцию обеспечивать лучшую стабильность pH в системах слива в отходы по сравнению с растворами, приготовленными с водой обратного осмоса. Эта вода содержит значительное количество карбонатов, которые превращаются в угольную кислоту и бикарбонат, как только рН снижается до диапазона рН, используемого в гидропонике. До тех пор, пока раствор используется быстрее, чем разлагается угольная кислота, стабильность pH будет существенно повышаться.
Если вы используете воду обратного осмоса или воду с низкой щелочностью для приготовления растворов, вы можете получить аналогичный эффект, добавив 100-200 частей на миллион карбоната калия перед началом приготовления питательного раствора, вы также можете использовать бикарбонат, но я бы рекомендовал использовать карбонат калия. , так как это дешевле. Также было бы целесообразно использовать раствор как можно быстрее, так как время приведет к тому, что раствор достигнет равновесия и рН увеличится. Этот эффект будет длиться намного дольше, если CO2 концентрация выше, что верно для установок, использующих обогащенный CO2 — или если температура ниже, что увеличивает растворимость CO2.