Стабильность хелатов металлов — Наука в гидропонике
![]()
![]()
![]()
![]()
Когда вы знакомитесь с гидропоникой и химией питательных растворов, одной из первых концепций, которую вы изучаете, является хелирование. Хелат — это молекула, образованная ионом металла и хелатирующим агентом, также называемым лигандом, где ион металла очень плотно обернут этим лигандом. Задача хелатирующего агента состоит в том, чтобы защитить ион тяжелого металла от окружающей среды, позволяя ему существовать в растворе без образования потенциально нерастворимых соединений, которые выводят его из питательного раствора. Однако эти хелаты могут быть нестабильными или слишком стабильными, что может препятствовать доступу питательных веществ к растениям. В этом посте мы поговорим о том, что определяет стабильность хелата металла и как узнать, сможет ли данный хелат выполнять свою работу в гидропонной среде.
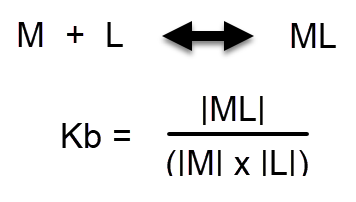
Поскольку хелаты образуются в результате реакции иона металла, чаще всего катиона, который является лигандом, устанавливается химическое равновесие между свободным ионом металла, лигандом и хелатом. Каждую секунду в результате реакций между ионами металлов и лигандами образуется множество молекул хелатов, а в результате разборки хелата образуются свободные ионы металлов и лиганды. Процесс находится в равновесии, когда скорости сборки и разборки одинаковы. Константа равновесия, также известная как константа стабильности или Kb, говорит нам, насколько это равновесие смещено в сторону продукта (в данном случае хелата). Когда значение Kb велико, концентрация хелата в равновесии очень велика, а когда Kb мало, верно обратное. Поскольку эти числа обычно очень велики для хелатов, мы выражаем их как pKb, что равно -Log(Kb). Эти константы зависят от температуры, но их значения не зависят от других химических реакций. Однако такие вещи, как pH, могут влиять на концентрацию лиганда или катиона металла, что может влиять на концентрацию хелата, поскольку значение константы равновесия остается неизменным.
| Аль (III) | Ба | Ca | Со (II) | Cu | Fe(II) | Fe(III) | ртутного столба | мг | Мн | В | старший | цинк | |
| Уксусная кислота | 0,39 | 0,53 | 2,24 | 3.7д | 0,51 | 0,74 | 0,43 | 1,03 | |||||
| Аденин | |||||||||||||
| адипиновая кислота | 1,92 | 2.19 | 3,35 | ||||||||||
| АДФ | 2,36 | 2,82 | 3,68 | 5,9 | 3.11 | 3,54 | 4,5 | 2,5 | 4,28 | ||||
| аланин | 0,8 | 1,24 | 4,82 | 8.18 | 3,24 | 5,96 | 0,73 | 5.16 | |||||
| b-аланин | 7.13 | 4,63 | 4 | ||||||||||
| Альбумин | 2.2 | ||||||||||||
| Аргинин | 3.2 | 2 | |||||||||||
| Аскорбиновая кислота | 0,19 | 0,35 | |||||||||||
| Аспарагин | 0 | 0,43 | |||||||||||
| Аспарагиновая кислота | 1.14 | 1,16 | 5,9 | 8,57 | 2,43 | 3,74 | 7.12 | 1,48 | 2,9 | ||||
| АТФ | 3,29 | 3,6 | 4,62 | 6.13 | 4 | 3,98 | 5.02 | 3.03 | 4,25 | ||||
| Бензойная кислота | 1,6 | 0,9 | 0,9 | ||||||||||
| н-масляная кислота | 0,31 | 0,51 | 2.14 | 0,53 | 0,36 | 1 | |||||||
| казеин | 2,23 | ||||||||||||
| Цитраконовая кислота | 1,3 | 1,3 | |||||||||||
| Лимонная кислота | 2.3 | 3,5 | 4.4 | 6.1 | 3.2 | 11,85 | 10.9д | 2,8 | 3.2 | 4,8 | 2,8 | 4,5 | |
| Цистеин | 9.3 | 19.2 | 6.2 | 14.4д | < 4 | 4.1 | 10.4 | 9,8 | |||||
| Дегидратуксусная кислота | 5.6 | 4.1 | |||||||||||
| Десферри-феррихризин | 29,9 | ||||||||||||
| десферри-феррихром | 29 | ||||||||||||
| Десферри-ферриоксамин Е | 11,8 | 13,7 | 32,5 | 12.2 | 12 | ||||||||
| 3,4-дигидроксибензойная кислота | 3,71 | 7,96 | 12,8 | 5,67 | 7.22 | 8,27 | 8,91 | ||||||
| Диметилглиоксим | 11,9 | 14,6 | 7.7 | ||||||||||
| O, O-диметилпурпурогаллин | 4,5 | 6,6 | 9.2 | 4.9 | 6.7 | 6,8 | |||||||
| ЭДТА | 16.13 | 7,78 | 10,7 | 16.21 | 18,8 | 14.3 | 25,7 | 21.5д | 8,69 | 13,6 | 18,6 | 8,63 | 16,5 |
| Муравьиная кислота | 0,6 | 0,8 | 1,98 | 3.1 | 0,66 | 0,6 | |||||||
| Фумаровая кислота | 1,59 | 2 | 2,51 | 0,99 | 0,54 | ||||||||
| Глобулин | 2,32 | ||||||||||||
| глюконовая кислота | 0,95 | 1,21 | 18,3 | 0,7 | 1 | 1,7 | |||||||
| Глютаминовая кислота | 1,28 | 1,43 | 5.06 | 7,85 | 4.6 | 1,9 | 3.3 | 5,9 | 1,37 | 5,45 | |||
| Глутаровая кислота | 2.04 | 1,06 | 2,4 | 1,08 | 0,6 | 1,6 | |||||||
| глицериновая кислота | 0,80 б | 1,18 | 0,86 | 0,89 | 1,8 | ||||||||
| Глицин | 0,77 | 1,43 | 5.23 | 8.22 | 4.3 | 10 | 10.3 | 3,45 | 3.2 | 6.1 | 0,91 | 5.16 | |
| Гликолевая кислота | 0,66 | 1.11 | 1,6 | 2,81 | 4.7 | 0,92 | 0,8 | 1,92 | |||||
| Глицилглицин | 1,24 | 3 | 6.7 | 2,62 | 9.1 | 1,34 | 2.19 | 4.18 | 3,91 | ||||
| Глицилсаркозин | 3,91 | 6,5 | 2,29 | 4,44 | |||||||||
| Гуанозин | 3.2 | 6 | 4.3 | 3 | 3,8 | 4.6 | |||||||
| гистамин | 5.16 | 9,55 | 9,6 | 3,72 | 6,88 | 5,96 | |||||||
| гистидин | 7.3 | 10,6 | 5,89 | 4 | 3,58 | 8,69 | 6,63 | ||||||
| б-гидроксимасляная | 0,43 | 0,6 | 0,6 | 0,47 | 1,06 | ||||||||
| 3-гидроксифлавон | 9,91 | 13.2 | 9,7 | ||||||||||
| инозин | 2,6 | 5 | 3 | 3.3 | |||||||||
| Инозинтрифосфат | 3,76 | 4,74 | 4.04 | 4,57 | |||||||||
| Феррихром без железа | 24,6 | ||||||||||||
| изовалериановая кислота | 0,2 | 2.08 | |||||||||||
| итаконовая кислота | 1,2 | 2,8 | 1,8 | 0,96 | 1,9 | ||||||||
| Койевая кислота | 7.7 | 2,5 | 7.11 | 6,6 | 9.2 | 3 | 7.4 | 4.9 | |||||
| Молочная кислота | 0,55 | 1,07 | 1,89 | 3.02 | 6.4 | 0,93 | 1.19 | 2.21 | 0,7 | 1,86 | |||
| Лейцин | 4,49 | 7 | 3,42 | 9,9 | 2,15 | 5,58 | 4,92 | ||||||
| лизин | 4,5 | 2.18 | |||||||||||
| Малеиновая кислота | 2,26 | 2,43 | 3,9 | 1,68 | 2 | 1.1 | 2 | ||||||
| Яблочная кислота | 1,3 | 1,8 | 3.4 | 1,55 | 2,24 | 1,45 | 2,8 | ||||||
| Метионин | 3,24 | 9.1 | 5,77 | 4,38 | |||||||||
| Метил салицилат | 5,9 | 9,77 | |||||||||||
| НТА | >10 | 4,82 | 6.41 | 10,6 | 12,7 | 8,84 | 15,87 | 5.41 | 7,44 | 11.3 | 4,98 | 10.45 | |
| Оротовая кислота | 6.39с | 6,82 | 6,42 | ||||||||||
| Орнитин | 4.02 | 6,9 | 3.09 | 8,7 | <2 | 4,85 | 4.1 | ||||||
| Щавелевая кислота | 7,26 | 2,31 | 3 | 4.7 | 6.3 | >4,7 | 9.4 | 2,55 | 3,9 | 5.16 | 2,54 | 4.9 | |
| b-фенилаланин | 7,74 | 3,26 | 8,9 | ||||||||||
| пимелиновая кислота | 1,08 | ||||||||||||
| пивалиновая кислота | 0,55 | 2.19 | |||||||||||
| Полифосфат | 3 | 3,5 | 3 | 3.2 | 5,5 | 3 | 2,5 | ||||||
| пролин | 4.07 | 10 | 3,34 | ||||||||||
| пропионовая кислота | 0,34 | 0,5 | 2.2 | 3,45 | 0,54 | 0,43 | 1.01 | ||||||
| Пурин | 6,9 | 4,88 | |||||||||||
| Пирофосфат | 5 | 6.7 | 22,2 | 5.7 | 5,8 | 8,7 | |||||||
| Пировиноградная кислота | 0,8 | 2.2 | |||||||||||
| Рибофлавин | 3,9 | <6 | 3.4 | 4.1 | <4 | ||||||||
| салициловый альдегид | 4,67 | 7.4 | 4.22 | 8,7 | 3,69 | 3,73 | 5.22 | 4,5 | |||||
| Салициловая кислота | 14.11 | 6,72 | 10,6 | 6,55 | 16.35 | 4.7 | 2,7 | 6,95 | 6,85 | ||||
| Саркозин | 4,34 | 7,83 | 3,52 | 9,7 | 5.41 | ||||||||
| серин | 1,43 | 3,43 | 9.2 | 5,44 | |||||||||
| Янтарная кислота | 1,57 | 1,2 | 2.08 | 3.3 | 7,49 | 1,2 | 2.11 | 2,36 | 0,9 | 1,78 | |||
| (+)-винная кислота | 1,95 | 1,8 | 3.2 | 7,49 | 1,36 | 3,78 | 1,94 | 2,68 | |||||
| тетраметафосфат | 4.9 | 5.2 | 3.18 | 5.17 | 4,95 | 2,8 | |||||||
| Треонин | 3.3 | 8,6 | |||||||||||
| триметафосфат | 2,5 | 1,55 | 1.11 | 3,57 | 3,22 | 1,95 | |||||||
| Трифосфат | 6.3 | 6,5 | 9,8 | 5,8 | 3,8 | 9,7 | |||||||
| Триптофан | 9 | ||||||||||||
| Уридин дифосфат | 3.17 | ||||||||||||
| Уридин трифосфат | 3,71 | 4,55 | 4.02 | 4,78 | |||||||||
| н-валериановая кислота | 0,2 | 0,3 | 2.12 | ||||||||||
| Валин | 7,92 | 3,39 | 9,6 | 2,84 | 5,37 | 5 | |||||||
| ксантозин | 2,8 | 3.4 | <2 | 3 | 2,4 |
В приведенной выше таблице показаны значения pKb для различных ионов металлов и различных лигандов или хелатирующих агентов. Поскольку шкала pKb является логарифмической, разница в 1 указывает на более высокую стабильность на порядок. Вы также можете найти дополнительные ссылки на другие константы стабильности по этой ссылке. Эти константы позволяют предсказать, какие хелаты будут образовываться при наличии различных катионов металлов и лигандов. Допустим, у нас есть раствор, содержащий Ca2+ и Fe3+, и мы добавляем небольшое количество цитрата натрия, что произойдет? Поскольку константа для Ca2+ равна 3,5, а для Fe3+ — 11,85, цитрат будет хелатировать около 1 миллиарда ионов Fe3+ на каждый ион Ca2+, который он хелатирует. На практике это означает, что весь Fe3+, который может быть хелатирован, будет хелатирован, а Ca2+ останется в виде свободного металлического иона. Однако, если у нас есть Fe2+ вместо Fe3+ затем Fe2+ имеет константу всего 3,2, что означает, что одна молекула Fe2+ будет хелатироваться на каждые 3 Ca2+что означает, что у нас будет около 25% всего хелата, образованного в виде хелата, образованного Fe2+ и 75% в виде хелата, образованного Ca2+.
Таким образом, мы можем видеть, как хелатирование только одного тяжелого металла может привести к проблемам. Представьте, что вы покупаете железную ЭДТА и добавляете ее в свой питательный раствор, но вы добавили марганец из сульфата марганца. При добавлении хелат FeEDTA будет разбираться, чтобы произвести как можно больше Fe.2+ и свободная ЭДТА, как диктуется константой равновесия, и свободная ЭДТА затем придет в равновесие со всеми другими тяжелыми металлами, поскольку константа с Mn равна 13,6, а константа Fe равна 14,3, лиганд перераспределится так, чтобы соответствовать всем условиям. присутствуют химические равновесия. Это означает, что на каждые 7 Fe2+ катионы, которые хелатируются, мы будем иметь около 1 Mn2+ содержащий хелат, поэтому вы потеряете около 14% хелатного железа, чтобы хелатировать свободный марганец. Этот свободный Fe2+ будет нестабильным и выпадет в осадок, что сместит равновесие и заставит нас потерять больше хелата Fe. Вот как конкурирующие равновесия могут привести к медленному, но верному истощению доступных катионов в растворе.
С помощью приведенных выше ссылок и диаграмм вы теперь сможете изучить любой хелатирующий агент, который хотите использовать, и определить, насколько он хорош для вашего раствора, и что, вероятно, произойдет, когда вы введете этот хелат. Лиганд будет хелатировать различные металлы, чтобы соблюдать все константы равновесия, поэтому вам решать, добавлять ли достаточно, чтобы все тяжелые металлы были удовлетворены, или добавлять лиганды, сродство которых к данному иону настолько велико, что другие просто не могут конкурировать за него. это, почти независимо от их концентрации.