Отличный трюк для повышения стабильности хелатов в гидропонике — Наука в гидропонике
![]()
![]()
![]()
![]()
Стабильность питательных микроэлементов в гидропонном растворе тщательно изучалась в течение последних 5 десятилетий (1). Молекула ЭДТА была первым дешевым синтетическим лигандом, создавшим высокостабильные хелаты, которые можно было использовать для стабилизации тяжелых металлов в растворе. После этого продолжались усилия по созданию более стабильных хелатов с введением HEDTA, DTPA, EDDHA и других синтетических лигандов. Однако стабильность железа в растворе все еще остается проблемой. Это связано с химическим составом тяжелых металлов в растворе и проблемами, возникающими при изменении химических условий корневой зоны в гидропонной культуре. В этом посте мы обсудим простой трюк для повышения стабильности дешевого хелата железа с ЭДТА, наиболее часто используемого в питательных растворах. Обратите внимание, что термин «тяжелый металл» в этом посте используется для обозначения переходных металлов, используемых в гидропонике, в основном Fe, Zn, Mn и Cu.

Хелатная стабильность
В стабильности хелатов преобладают три конкурирующие силы. Во-первых, это кислотно-основное равновесие лиганда. Лиганды, такие как ЭДТА, способны хелатировать Fe только тогда, когда их активные центры не заняты ионами водорода. По мере снижения pH эти участки становятся занятыми, и ЭДТА-4 превращается в ГЕДТА-3то Х2ЭДТА-2ч3ЭДТА-1и, наконец, Х4ЭДТА. Этот процесс высвобождает ионы тяжелых металлов, так как концентрация активного лиганда (ЭДТА-4) падает почти до нуля. При очень кислых значениях pH Fe2+ фактически станет полностью нехелатированным из-за этого эффекта, хотя это не происходит в очень большой степени при значениях pH, которые мы наблюдаем в гидропонике.
Второй эффект связан со сродством лиганда к тяжелому металлу. Это то, что мы называем «стабильностью» хелата. Его измеряют с помощью константы равновесия реакции металла с лигандом. Чем больше это значение, тем выше будет стабильность хелата и тем меньше свободного металла будет в растворе. Для получения дополнительной информации об этом вы можете прочитать этот предыдущий пост, где я делюсь таблицей с большим количеством констант стабильности для различных лигандов и тяжелых металлов.
В-третьих, это осаждение свободных ионов тяжелых металлов путем образования нерастворимых твердых веществ. Это может быть очень важно, так как некоторые твердые вещества, которые могут образовываться в гидропонике, в основном гидроксиды и фосфаты, имеют очень низкие значения растворимости. Их можно сравнить, используя константу равновесия твердого тела с ионами в растворе, которую в химии мы называем Ksp. Чем меньше Ksp, тем более нерастворимым является вещество. Когда эти твердые вещества выпадают в осадок, они забирают ионы из раствора, и они регенерируются в результате равновесной реакции хелатного тяжелого металла. Это медленно истощает тяжелый металл из раствора.
Свободные ионы тяжелых металлов
Поскольку свободные ионы тяжелых металлов могут осаждаться и становиться недоступными, мы хотим снизить количество свободных ионов тяжелых металлов в растворе и увеличить процент хелатированных ионов. Всякий раз, когда вы помещаете в раствор хелатный источник тяжелых металлов, например, Na2FeEDTA, хелат приходит в равновесие со своей нехелатной формой и всеми кислотно-основными видами равновесных реакций лиганда. Это означает, что часть Fe становится эффективно нехелатированной. В растворе, где 1 ppm Fe из Na2Добавляется FeEDTA, P добавляется в количестве 30 частей на миллион, а pH устанавливается на 6, около 0,38% Fe будет нехелатировано..
По мере увеличения pH количество свободного Fe на самом деле уменьшается — поскольку кислотно-щелочное равновесие лиганда смещается в сторону основных форм — но концентрация других ионов, которые могут осаждать действительно нерастворимые соли, такие как фосфат или гидроксид, резко возрастает. При значениях рН выше 7 даже небольшая доля свободного Fe может приводить к осаждению некоторых солей Fe. Вот почему хелаты железа с ЭДТА не считаются стабильными при щелочном pH не потому, что сам хелат нестабилен, а потому, что существуют еще более стабильные твердые частицы Fe, которые могут образовываться и осаждаться из Fe.
Простой трюк, чтобы облегчить проблему
Традиционно проблема наличия нехелатированных тяжелых металлов решалась путем создания более сильных хелатов. DTPA, который имеет гораздо более высокие константы стабильности, способен генерировать гораздо меньшие количества Fe, что приводит к меньшему осаждению. Константа равновесия с некоторыми изомерами ЭДДГК на самом деле настолько высока, что твердые частицы Fe не образуются почти во всем интервале рН в воде. Однако эти хелаты дороже, а в случае с ЭДДГК наличие нескольких разных изомеров усложняет ситуацию.
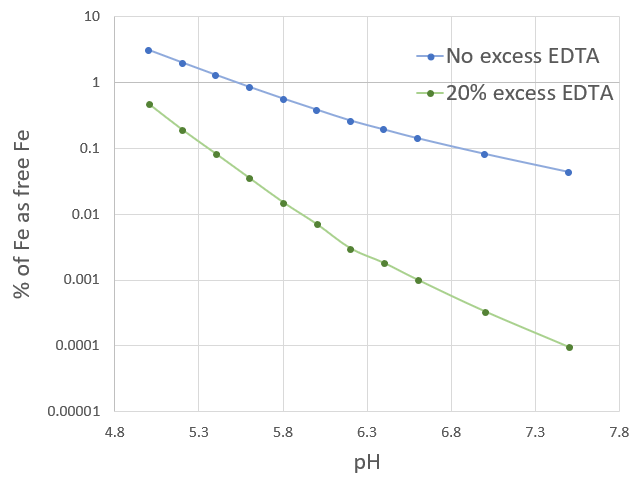
Очень простой способ частично решить проблему — добавить избыток хелатирующего агента в гидропонный раствор. Если вы используете ЭДТА, добавьте Na2ЧАС2ЭДТА поверх хелатов тяжелых металлов может значительно помочь уменьшить количество свободного тяжелого металла в растворе. Эта ЭДТА также не останется несвязанной, так как быстро хелатирует Mg и Ca в растворе. Эти хелаты Ca и Mg будут действовать как резерв лиганда, чтобы обеспечить хелатирование почти всех ионов тяжелых металлов. 20-процентный молярный избыток может дать впечатляющие результаты в случае Fe.2+, как показано на изображении выше. Этот 20% «запасной» лиганд снижает количество свободного Fe в 10-100 раз, в зависимости от pH. Обратите внимание, что, хотя вышеизложенное замедляет любые реакции осаждения — поскольку свободного Fe доступно мало — ионы гидроксида и фосфата все равно будут выигрывать, если pH достаточно увеличится, поскольку константа стабильности реакции Fe с ЭДТА остается неизменной.
Чтобы получить 20-процентный избыток ЭДТА в молярном выражении, добавьте 1,2 мг/л динатриевой соли ЭДТА в конечный питательный раствор на каждый 1 ч/млн Fe. Также можно добавлять 100% молярный избыток без вредного воздействия на растения, что обеспечит более выраженный эффект.
Заключение
Добавление хелатной формы тяжелого металла в гидропонный раствор не гарантирует, что металл всегда будет хелатным. Химическое равновесие, которое существует со свободной формой тяжелого металла, всегда имеет место и всегда будет генерировать некоторый процент свободного, нехелатированного металла. Добавляя избыток хелатирующего агента, в данном случае Na2ЧАС2ЭДТА, мы можем сильно сместить равновесие и уменьшить количество присутствующего свободного тяжелого металла. Меньшее количество тяжелого металла увеличивает диапазон pH-стабильности хелата и уменьшает проблемы осаждения, возникающие вследствие присутствия в растворе свободных ионов тяжелых металлов.
Добавляете ли вы избыток хелатирующего агента в свои питательные растворы? Дайте нам знать о своем опыте в комментариях!