Кальций ЭДТА и его проблемы в гидропонике — Наука в гидропонике
![]()
![]()
![]()
![]()
Кальций в основном используется в гидропонике в виде нитрата кальция, учитывая, что это очень растворимая и распространенная форма кальция. Однако это не единственный способ подачи кальция растениям, и существует множество других источников кальция. Среди них мы находим сульфат кальция, хлорид кальция, гидрофосфат кальция, цитрат кальция, глюконат кальция и ЭДТА кальция. Эта последняя форма, хелат кальция с ЭДТА, является одной из самых дешевых форм хелатного кальция, но несет с собой некоторые существенные проблемы в гидропонной культуре. В этой статье мы поговорим о Ca EDTA, ее преимуществах и проблемах при использовании в качестве добавки к кальцию в гидропонике.
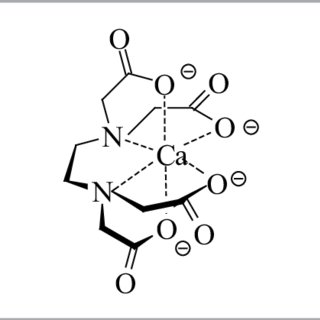
Говоря о Ca EDTA, мы должны в первую очередь понимать, что это не просто ион кальция с обернутой вокруг него молекулой EDTA. На самом деле продукт, который мы покупаем как Ca EDTA, который содержит 9,7% Ca по весу, на самом деле химически представлен как C.10ЧАС12О8Может2Уже22 часа2O. Продукт Ca EDTA на самом деле состоит из четырех частей, нескольких кристаллизационных вод, Ca+2 катион, анион хелатирующего агента, который обволакивает его (ЭДТА-4) и два катиона натрия, Na+которые используются для противодействия двум избыточным отрицательным зарядам, исходящим от Ca EDTA (которую нам следует более точно назвать (Ca EDTA)-2). При добавлении Ca EDTA мы фактически добавляем четыре вещи: немного воды, Ca, EDTA и Na. Самое главное, Ca EDTA на самом деле содержит 12,15% натрия, а это означает, что вы добавляете больше Na, чем Ca, когда используете его.
Из-за вышеизложенного, думать о Ca EDTA как о какой-либо значительной части кальциевого питания растений будет проблемой. Добавление 100 частей на миллион Ca через это химическое вещество означает добавление более 100 частей на миллион Na. Это добавление натрия может начать сильно вредить растениям по мере достижения все более и более высоких значений (прочитайте мою статью о натрии в гидропонике, чтобы узнать больше). Несмотря на то, что научной литературы по использованию Са ЭДТА не так много, мы находим некоторые отчеты, в которых говорится о тяжелых токсических эффектах при концентрациях около 2,5 мМ (940,7 частей на миллион), что дает около 90 частей на миллион Са в растворе.
Еще одним важным аспектом, который следует учитывать, является сама молекула ЭДТА. Хелат ЭДТА никоим образом не является пассивным и не связан ковалентно с кальцием, поэтому может легко удаляться. Поскольку он довольно слабо связывается с кальцием, он захочет обменять кальций на что-нибудь другое, что покажется ему более привлекательным. Это создает серьезную проблему при применении его в растворе, поскольку ЭДТА в Ca ЭДТА может диссоциировать от Са и присоединяться к другому иону, который он считает более привлекательным, он предпочитает тяжелые металлы, поэтому это может фактически вызвать извлечение таких вещей, как свинец, из среды. Это может быть важным соображением при использовании в тех случаях, когда среда может содержать значительное количество тяжелых металлов.
Еще одна интересная проблема, о которой я нигде больше не упоминал и знаю только экспериментально, заключается в том, что на самом деле CaEDTA-2 анион может образовывать нерастворимые соли с самим Са. Это означает, что вы действительно можете осадить Ca(CaEDTA) в растворах с высокой концентрацией обоих ионов. Это важная причина, по которой очень трудно правильно приготовить концентрированные растворы Ca EDTA и Ca нитрата, потому что, как только вы преодолеете предел растворимости Ca (Ca EDTA), вы начнете видеть, как он кристаллизуется из раствора. Многие люди задаются вопросом, почему что-то выпадает в осадок из раствора, состоящего из двух хорошо растворимых солей кальция, причина в том, что ЭДТА кальция не является нейтральным соединением, но может образовывать соль со свободным кальцием. Ca EDTA определенно требует своего собственного концентрированного раствора большую часть времени.
Так зачем кому-то использовать CaEDTA, учитывая вышеприведенный набор очень важных проблем? У нее есть некоторые преимущества, которые делают ее хорошей солью для некоторых применений, особенно для опрыскивания листвы. Во-первых, он не собирается легко осаждаться из растворов из-за анионов, поэтому он может оставаться в высокой концентрации с анионами, которые обычно осаждались бы в виде солей кальция в присутствии свободного кальция. Это может быть интересно в случае некоторых анионов, таких как салицилаты, которые часто используются в качестве стимуляторов роста растений (вы можете увидеть это конкретное использование в этой статье). Это также одна из единственных форм кальция, которая поглощается растением в виде аниона, поэтому именно кальций может попасть в растение, не конкурируя с другими катионами в их транспортных каналах. Поэтому в некоторых случаях кальций можно очень успешно использовать для внекорневых подкормок (1).
Хотя для CaEDTA могут быть некоторые нишевые приложения, в частности, для проведения некоторых экспериментов, которые были бы невозможны с обычными солями Ca, есть также некоторые очень важные проблемы с его использованием в гидропонной культуре. Если вы планируете использовать его, я бы посоветовал вам тщательно изучить его химический состав в растворе и взаимодействие с другими веществами, которые будут с ним находиться, особенно в исходных растворах. Вам также следует учитывать количество добавляемого натрия и желательно избегать его использования в растворах для кормления, если вы тщательно не рассмотрели все вышеперечисленное и его преимущества более важны для вашего конкретного случая использования.